- Avtor Alex Aldridge [email protected].
- Public 2023-12-17 13:49.
- Nazadnje spremenjeno 2025-06-01 07:37.
Ključna razlika med ogljikovo kislino in bikarbonatom je v tem, da je ogljikova kislina nevtralna kemična spojina, medtem ko je bikarbonat negativno nabita kemična spojina.
Ogljikova kislina je šibka kislina, ki nastane v raztopini, ko se ogljikov dioksid raztopi v vodi, s kemijsko formulo H2CO3. Bikarbonat nastane s kombinacijo treh atomov kisika, atoma vodika in atoma ogljika s kemijsko formulo HCO3-.
Kaj je karbonska kislina?
Ogljikova kislina je H2CO3. Včasih to ime damo raztopinam, ki vsebujejo ogljikov dioksid, raztopljen v vodi ali gazirani vodi. To je zato, ker gazirana voda vsebuje majhno količino H2CO3. Poleg tega je ogljikova kislina šibka kislina in lahko tvori dve vrsti soli, kot so karbonati in bikarbonati. Molska masa te spojine je 62,024 g/mol.
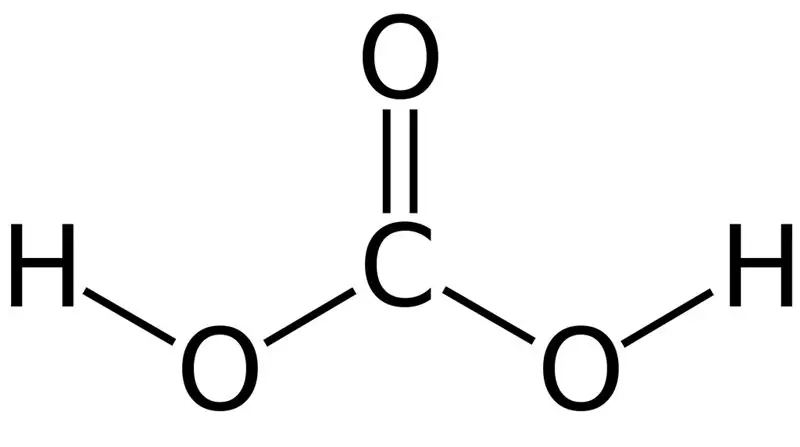
Slika 01: Kemijska struktura ogljikove kisline
Ko se ogljikov dioksid raztopi v vodi, pride v ravnovesje med ogljikovim dioksidom in ogljikovo kislino. Ravnovesje je naslednje:
CO2 + H2O ⟷ H2CO3
Če bazi dodamo presežek ogljikove kisline, dobimo bikarbonat. Toda, če je baza v presežku, potem ogljikova kislina daje karbonizirane soli. Natančneje, ogljikova kislina je spojina karboksilne kisline, ki ima dva substituenta hidroksilne skupine, vezana na karbonilni ogljik. Poleg tega je poliprotična kislina, ki je sposobna oddajati protone. Ima dva odstranljiva protona, zato je specifično diprotična.
Kaj je bikarbonat?
Bikarbonat nastane s kombinacijo treh atomov kisika, atoma vodika in atoma ogljika. Produkt te kombinacije je lahko ion ali spojina z več elektroni kot protoni. Lahko ga opišemo kot kemično vrsto s kemijsko formulo HCO3-.
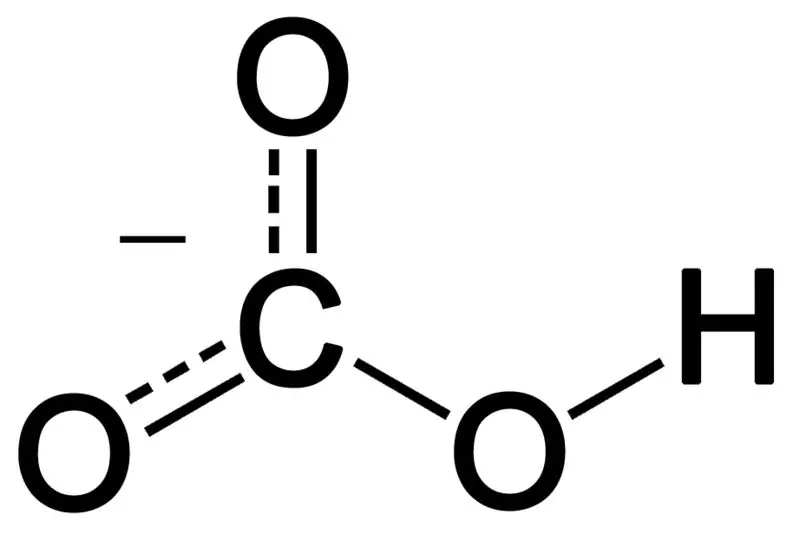
Slika 02: Kemijska struktura bikarbonatnega aniona
Ta spojina je ključen del telesnega sistema za pufrovanje pH, povedano laično: odgovorna je za ohranjanje krvi v stanju, ki ni preveč kislo ali preveč bazično. Poleg tega služi kot način zadrževanja prebavnih sokov pod nadzorom, ko želodec konča s prebavo hrane. Poleg tega ogljikova kislina v deževnici tvori bikarbonatne ione, ko zadene kamenje. Ta pretok bikarbonatnih ionov je pomemben za ohranjanje ogljikovega cikla.
Kakšna je razlika med ogljikovo kislino in bikarbonatom?
Ogljikova kislina je šibka kislina, ki nastane v raztopini, ko se ogljikov dioksid raztopi v vodi, njena kemijska formula pa je H2CO3. Bikarbonat nastane s kombinacijo treh atomov kisika, atoma vodika in atoma ogljika s kemijsko formulo HCO3-. Ključna razlika med ogljikovo kislino in bikarbonatom je, da je ogljikova kislina nevtralna kemična spojina, medtem ko je bikarbonat negativno nabita kemična spojina. Poleg tega se ogljikova kislina uporablja pri pripravi mehurčkov, gaziranih pijač, zdravljenju dermatitisov, za izpiranje ust itd., medtem ko se bikarbonat uporablja pri pripravi hrane, kot je peka (kot sredstvo za vzhajanje), in daje sposobnost, da se upre spremembam pH.
Naslednja infografika povzema razlike med ogljikovo kislino in bikarbonatom v obliki tabele za vzporedno primerjavo.
Povzetek - ogljikova kislina proti bikarbonatu
Ogljikova kislina je H2CO3. Bikarbonat nastane s kombinacijo treh atomov kisika, atoma vodika in atoma ogljika, s kemijsko formulo HCO3-. Ključna razlika med ogljikovo kislino in bikarbonatom je, da je ogljikova kislina nevtralna kemična spojina, medtem ko je bikarbonat negativno nabita kemična spojina.






