- Avtor Alex Aldridge [email protected].
- Public 2023-12-17 13:49.
- Nazadnje spremenjeno 2025-06-01 07:37.
Ključna razlika - močan ligand proti šibkemu ligandu
Ligand je atom, ion ali molekula, ki odda ali deli dva svoja elektrona preko koordinatne kovalentne vezi s centralnim atomom ali ionom. Koncept ligandov je obravnavan v koordinacijski kemiji. Ligandi so kemične vrste, ki sodelujejo pri tvorbi kompleksov s kovinskimi ioni. Zato so znani tudi kot kompleksna sredstva. Ligandi so lahko monodentatni, bidentatni, tridentatni itd. Glede na gostoto liganda. Dentičnost je število donorskih skupin, prisotnih v ligandu. Monodentatno pomeni, da ima ligand samo eno donorsko skupino. Bidentat pomeni, da ima dve donorski skupini na eno molekulo liganda. Obstajata dve glavni vrsti ligandov, razvrščenih na podlagi teorije kristalnega polja; močni ligandi (ali ligandi močnega polja) in šibki ligandi (ali ligandi šibkega polja). Ključna razlika med močnimi in šibkimi ligandi je v tem, da cepitev orbital po vezavi na ligand močnega polja povzroči večjo razliko med orbitalami višje in nižje ravni energije, medtem ko cepitev orbital po vezavi na ligand šibkega polja povzroči manjšo razliko med orbitalami višje in nižje ravni energije.
Kaj je teorija kristalnega polja?
Teorijo kristalnega polja lahko opišemo kot model, ki je zasnovan za razlago razbitja degeneracij (elektronskih lupin enake energije) elektronskih orbital (običajno d ali f orbital) zaradi statičnega električnega polja, ki ga povzroča okoliško anion ali anioni (ali ligandi). Ta teorija se pogosto uporablja za prikaz obnašanja kompleksov prehodnih kovinskih ionov. Ta teorija lahko pojasni magnetne lastnosti, barve koordinacijskih kompleksov, hidratacijske entalpije itd.
Teorija:
Interakcija med kovinskim ionom in ligandi je posledica privlačnosti med kovinskim ionom s pozitivnim nabojem in negativnim nabojem nesparjenih elektronov liganda. Ta teorija temelji predvsem na spremembah, ki se zgodijo v petih degeneriranih elektronskih orbitalah (kovinski atom ima pet d orbital). Ko se ligand približa kovinskemu ionu, so nesparjeni elektroni bližje nekaterim d orbitalam kot drugim d orbitalam kovinskega iona. To povzroči izgubo degeneracije. Poleg tega elektroni v d orbitalah odbijajo elektrone liganda (ker sta oba negativno nabita). Zato imajo d orbitale, ki so bližje ligandu, visoko energijo kot druge d orbitale. Posledica tega je cepitev d orbital na visokoenergijske d orbitale in nizkoenergetske d orbitale na podlagi energije.
Nekateri dejavniki, ki vplivajo na to delitev, so; narava kovinskega iona, oksidacijsko stanje kovinskega iona, razporeditev ligandov okoli osrednjega kovinskega iona in narava ligandov. Po razdelitvi teh d orbital na podlagi energije je razlika med visoko in nizkoenergijskimi d orbitalami znana kot parameter cepitve kristalnega polja (∆oct za oktaedrske komplekse).
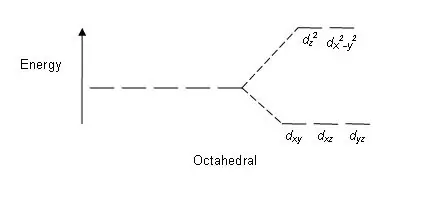
Slika 01: Razcepni vzorec v oktaedrskih kompleksih
Vzorec cepitve: Ker obstaja pet d orbital, pride do cepitve v razmerju 2:3. V oktaedrskih kompleksih sta dve orbitali na visoki energijski ravni (skupno znani kot 'eg'), tri orbitale pa na nižji energijski ravni (skupno znani kot t2g). V tetraedrskih kompleksih se zgodi nasprotno; tri orbitale so na višji energijski ravni, dve pa na nižji.
Kaj je močan ligand?
Močan ligand ali ligand močnega polja je ligand, ki lahko povzroči višjo cepitev kristalnega polja. To pomeni, da vezava liganda močnega polja povzroči večjo razliko med orbitalami višje in nižje ravni energije. Primeri vključujejo CN- (cianidni ligandi), NO2- (nitro ligand) in CO (karbonil ligandi).
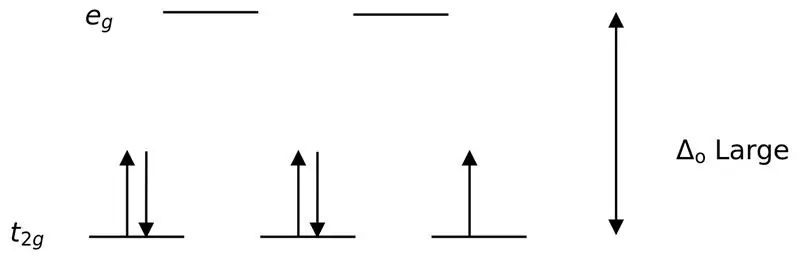
Slika 02: Razdelitev z nizkim vrtenjem
Pri tvorbi kompleksov s temi ligandi so najprej orbitale z nižjo energijo (t2g) popolnoma napolnjene z elektroni, preden se napolnijo do katere koli druge orbitale z visoko energijsko stopnjo (npr.). Kompleksi, ki nastanejo na ta način, se imenujejo "kompleksi z nizkim spinom".
Kaj je šibek ligand?
Šibek ligand ali ligand šibkega polja je ligand, ki lahko povzroči cepitev nižjega kristalnega polja. To pomeni, da vezava liganda šibkega polja povzroči nižjo razliko med orbitalami višje in nižje ravni energije.
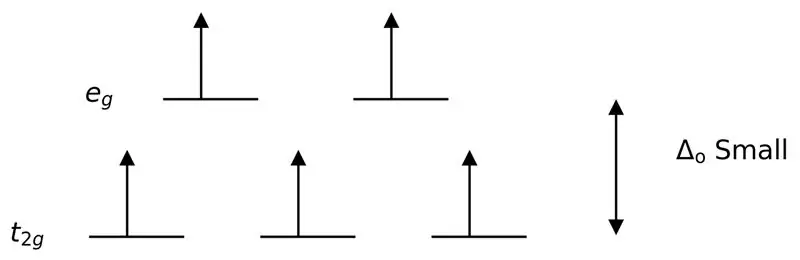
Slika 3: Razdelitev z visokim vrtenjem
V tem primeru, ker nizka razlika med dvema orbitalnima nivojema povzroča odboje med elektroni na teh energijskih nivojih, se lahko orbitale z višjo energijo zlahka napolnijo z elektroni v primerjavi s tistimi v orbitalah z nizko energijo. Kompleksi, ki nastanejo s temi ligandi, se imenujejo "high spin kompleksi". Primeri ligandov šibkega polja vključujejo I- (jodidni ligand), Br- (bromidni ligand) itd.
Kakšna je razlika med močnim ligandom in šibkim ligandom?
Močan ligand proti šibkemu ligandu |
|
| Močan ligand ali ligand močnega polja je ligand, ki lahko povzroči cepitev višjega kristalnega polja. | Šibek ligand ali ligand šibkega polja je ligand, ki lahko povzroči cepitev nižjega kristalnega polja. |
| Teorija | |
| Cepitev po vezavi liganda močnega polja povzroči večjo razliko med orbitalami višje in nižje ravni energije. | Cepitev orbital po vezavi liganda šibkega polja povzroči manjšo razliko med orbitalami višje in nižje ravni energije. |
| Kategorija | |
| Kompleksi, ki nastanejo z ligandi močnega polja, se imenujejo "kompleksi z nizkim spinom". | Kompleksi, ki nastanejo z ligandi šibkega polja, se imenujejo "high spin kompleksi". |
Povzetek - močan ligand proti šibkemu ligandu
Močni ligandi in šibki ligandi so anioni ali molekule, ki povzročijo cepitev d orbital kovinskega iona na dva energijska nivoja. Razlika med močnimi ligandi in šibkimi ligandi je v tem, da cepitev po vezavi liganda z močnim poljem povzroči večjo razliko med orbitalami z višjo in nižjo energijsko ravnijo, medtem ko cepitev orbital po vezavi liganda s šibkim poljem povzroči manjšo razliko med višjimi in nižjimi ligandi. orbitale energijske ravni.






